Prueba de Remdesivir en el Centro Médico Penn State Health Milton S. Hershey muestra esperanza, añade una segunda terapia al protocolo

El Centro Médico Penn State Health Milton S. Hershey ha ingresado los primeros pacientes en la continuación de una prueba clínica usando la droga antiviral en investigación remdesivir para el tratamiento del COVID-19. La porción inicial de la Prueba Adaptiva de Tratamiento para el COVID-19 (ACTT, por sus siglas en inglés), patrocinado por el Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID, por sus siglas en inglés) terminó a mediados de abril y mostró que remdesivir puede acelerar la recuperación de los pacientes con COVID-19 severo.
El Centro Médico Milton S. Hershey es uno de aproximadamente 100 hospitales internacionales participando en la continuación del estudio y es el único hospital en Pensilvania central que está participando en la prueba clínica.
Todos los participantes en la próxima repetición, ACCT 2, por sus siglas en inglés, serán administrado o una droga anti-inflamatoria que se llama baricitinib o un placebo que contiene ingredientes inactivos. Baricitinib ya está aprobado por el FDA (por sus siglas en inglés) en los EEUU y más que 65 países adicionales como tratamiento para los adultos con artritis reumatoide moderado a severo. Se toma oralmente y ayuda inhibir o parar la señalización de cytokine en el cuerpo que juega un papel en causar las respuestas inflamatorias. La combinación de baricitinib y remdesivir como tratamiento para COVID-19 no ha sido evaluado en una prueba grande, aleatoria controlada hasta ahora.
“Información del ACTT muestra que remdesivir corta el tiempo de recuperación para las personas hospitalizadas con COVID-19,” dijo investigadora principal en el sitio, Dr. Catharine Paules, una médica de enfermedades infecciosas en el Centro Médico Hershey y una profesora asistente de medicina en la Facultad de Medicina de Penn State. “Ya que sabemos que remdesivir tiene un impacto modesto positivo en los resultados de los pacientes, queremos ver si podemos aumentar ese éxito. La continuación de la prueba asesorará si juntar remdesivir con la droga anti-inflamatoria baracitinib lleva a un mejoramiento en resultados.”
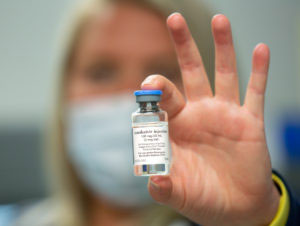
Allyson Curry, la compradora/inventario con el departamento de Farmacia en el Centro Médico Penn State Health Milton S. Hershey lleva una botella de remdesivir en la farmacia.
El estudio es un doble-ciego, que quiere decir que ni los investigadores ni los pacientes saben quién recibe baricitinib y quién no. La participación es voluntario y abierto a pacientes adultos hospitalizados con COVID-19 quienes cumplen con cierto criterio y entregan su consentimiento. Los individuales con síntomas leves o no aparentes no serán incluidos en el estudio. Como con cualquier medicamento, efectos secundarios pueden ser posibles con remdesivir y baricitinib.
La porción inicial del ACTT ingresó 1,063 pacientes con COVID-19 moderado a severo en 73 sitios nacionales e internacionales, incluyendo el Centro Médico Hershey. Un cuerpo independiente de vigilancia de información y seguridad repasó la información y notó que los pacientes dados remdesivir tenían una recuperación más corta comparado a los que recibieron un placebo. El tiempo de recuperación se detalló como estar lo suficiente saludable para darse de alto del hospital o regresar a su nivel normal de actividad.
La Administración de Alimentos y Drogas del EEUU (FDA, por sus siglas en inglés) ha entregado una autorización para el uso de emergencia (EUA, por sus siglas en inglés) de remdesivvir como tratamiento para COVID-19. Esto dará a hospitales adicionales en el país acceso al remdesivir fuera de la prueba clínica. El EUA es temporal y no reemplaza el proceso formal de aplicación, sumisión, repaso y aprobación para una droga nueva.
El gobierno federal está coordinando la distribución de remdesivir a hospitales en las ciudades afectadas más fuerte por COVID-19 debido a la disponibilidad limitada. Hasta la fecha, ambos hospitales de Penn State Health han recibido asignaciones de autorización para el uso de emergencia remdesivir.
Para información adicional, vea ClinicalTrials.gov.
Esta investigación está apoyada por los Institutos Nacionales de Salud. El contenido es solamente la responsabilidad de los autores y no necesariamente representa las perspectivas oficiales del NIH (por sus siglas en inglés).
Si Usted tiene dificultad al ver este contenido, o prefiere tenerlo en otro formato, favor de comunicarse por correo eléctronico a Penn State Health Marketing & Communications.
If you're having trouble accessing this content, or would like it in another format, please email the Penn State College of Medicine web department.
